Cell Rep:上海交通大学刘德军等团队合作揭示CLIC1作为促进胰腺癌肿瘤生长关键介质的作用机理
2024-08-24 iNature iNature 发表于上海
该研究整合了临床、细胞和生物信息学方法来探索基质硬度和PDAC中的瓦博格效应之间的联系,并确定CLIC1是关键介质。
胰腺导管腺癌(PDAC)具有显著的基质硬化和重编程的葡萄糖代谢,特别是瓦博格效应。然而,这些特征之间的复杂相互作用及其对肿瘤进展的影响仍未得到充分探索。
2024年8月17日,上海交通大学刘德军、孙勇伟、刘巍及霍砚淼共同通讯在Cell Reports 在线发表题为“A CLIC1 network coordinates matrix stiffness and the Warburg effect to promote tumor growth in pancreatic cancer”的研究论文,该研究整合了临床、细胞和生物信息学方法来探索基质硬度和PDAC中的瓦博格效应之间的联系,并确定CLIC1是关键介质。
基质硬度通过Wnt/β-catenin/TCF4信号传导诱导的CLIC1表达升高表明PDAC的预后结果较差。从功能上讲,CLIC1可作为糖酵解代谢的催化剂,促进肿瘤增殖。从机制上讲,CLIC1通过抑制活性氧(ROS)的羟基化来增强HIF1α的稳定性。总的来说,PDAC细胞以基质硬度响应的方式提高CLIC1水平,增强瓦博格效应以通过ROS/HIF1α信号传导驱动肿瘤生长。作者的见解强调了同时解决基质特性和代谢重组的靶向治疗的机会,其中CLIC1成为一个有希望的干预点。
未转化的细胞外基质(ECM)通过其免疫功能以及血管和结缔组织成分,在损伤后具有维持体内平衡的重要支持功能。然而,癌症劫持了这种生理反应并诱导周围组织基质的变化,为其快速生长创造了有利的肿瘤微环境(TME)。ECM是TME中最丰富的非细胞固体成分,不仅维持肿瘤组织的三维形态结构,而且还通过生化或生物物理信号影响肿瘤细胞的生物学特性。ECM蛋白在实体肿瘤中的沉积、重塑和交联导致基质僵硬的机械和物理特性。胰腺导管腺癌(PDAC)作为一种富含ECM的癌症类型,更凸显了这一特征。致密的ECM不仅在物理上阻塞血管系统,限制静脉治疗药物的输送,而且还会诱发缺氧并抑制肿瘤免疫力。这些与ECM僵硬相关的僵硬反过来会损害肿瘤内信号通路,例如上皮转化生长因子β(TGF-β),并进一步驱动经典的PDAC启动子,例如STAT3活化和SMAD4突变。因此,肿瘤的恶性进展和患者预后不良与PDAC的高度纤维化性质有关。
基质在PDAC的多个特征中的作用,如增殖、侵袭、转移、细胞凋亡、血管生成、淋巴管生成和免疫逃逸,已得到充分证实,其中ECM通常被认为是肿瘤的保护屏障和关键刺激物。然而,其对生物物理信号的影响研究较少。与退化相似,ECM的僵硬是实体肿瘤最突出的机械和物理特性之一,这是由肿瘤细胞和作为主要ECM成分的癌症相关成纤维细胞(CAFs)之间复杂的多向相互作用引起的。它改变细胞表面的稳态力,并将外源性基质产生的机械信号传递给细胞,进而诱导细胞的生物学行为,如外泌体分泌和癌症干细胞富集,以及内部信号通路的激活,最终影响肿瘤细胞的上皮间质转化、代谢变化、侵袭和转移。鉴于这些考虑,作者可以假设,通过阐明ECM在PDAC中的作用和机制,针对PDAC肿瘤微环境的机械特性,特别是通过调节ECM硬度,可能为这种致命疾病提供一种新的治疗途径。
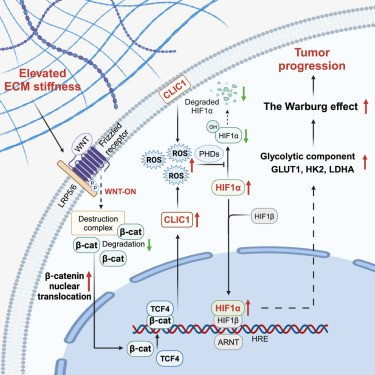
图形摘要(图源自Cell Reports )
细胞代谢最近已发展成为受机械信号调控的过程之一。代谢重编程以满足肿瘤的能量和物质需求是肿瘤的核心特征之一。有趣的是,ECM僵硬最近有报道称参与代谢重编程的复杂调节,包括碳水化合物代谢,如葡萄糖摄取和有氧糖酵解,脂质代谢,如脂肪酸吸收和降解,以及氨基酸代谢,如谷氨酰胺和天冬氨酸交换。在这些过程中,肿瘤细胞即使在充足的氧气供应条件下也倾向于通过糖酵解获取能量,这被称为Warburg效应。
重要的是,与乳腺癌等富含基质的肿瘤不同,无论是在患者来源的组织还是小鼠模型中,Warburg效应仍然是PDAC中检测到的主要代谢效应。此外,Warburg效应与促进PDAC细胞在具有间充质丰富TME的肿瘤微环境内的存活和增殖更相关。此外,针对Warburg效应可以有效抑制肿瘤进展。因此,阐明Warburg效应过程的核心调控因子对于开发PDAC的治疗靶点至关重要。但另一方面,值得注意的是,TME,特别是ECM僵硬性在PDAC的Warburg效应过程中的作用尚未完全阐明。这些事实迫切需要研究揭示ECM僵硬性与Warburg效应之间的关联,以期找到新的治疗靶点或疗效预测标志物。
氯离子胞内通道1(CLIC1)是氯离子胞内通道蛋白家族的成员,不仅具有潜在的离子通道活性,还可能参与细胞内的氧化应激、细胞信号传导、酸化和细胞周期调控。引人注目的是,越来越多的研究强调了CLIC1在癌症中的作用。CLIC1在多种肿瘤组织中高表达,已被证明是一种可促进免疫逃逸和肿瘤转移的致癌蛋白。例如,乙酰化稳定的CLIC1通过核因子κB(NF-κB)激活在宫颈癌细胞中起致瘤作用。此外,CLIC1通过PIP5K/PIP2/talin/integrin/adhesion信号通路协调板状伪足和侵袭性伪足的空间和时间形成,以促进肿瘤侵袭和转移。然而,在TME内介导CLIC1的潜在机制仍然很大程度上未知。
在这里,作者描述了CLIC1作为连接肿瘤基质硬度和PDAC中的瓦博格效应的桥梁发挥作用。作者发现肿瘤细胞可以感知ECM硬度并激活Wnt/β-catenin/TCF4信号通路,从而导致CLIC1表达上调。CLIC1是与瓦博格效应有关的关键调节器,促进糖酵解依赖性肿瘤生长。总的来说,这项研究揭示了PDAC中组织力学、机械转导信号和代谢重塑之间的独特融合点。
参考消息:
https://www.cell.com/cell-reports/fulltext/S2211-1247(24)00983-5#%20
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#胰腺导管腺癌# #瓦博格效应# #CLIC1#
100