JCO:化疗联合抗血管生成药物治疗难治/复发神经母细胞瘤
2024-03-12 儿童肿瘤前沿 儿童肿瘤前沿 发表于上海
贝伐单抗-伊立替康-替莫唑胺在该研究中取得了较好的结果,然而B治疗组的患者比非B组的患者出现了更多的不良事件,IT组和TTo组也比单独接受T治疗的患者发生的不良事件更多。
神经母细胞瘤是导致儿童癌症死亡的主要原因之一。尽管过去几十年对许多靶向疗法和新型疗法进行了评估,一线疗法也有所改进,但神经母细胞瘤的长期结局仍然不佳,难治性/复发性神经母细胞瘤患儿的 5 年生存率不到 20%。过去20年对二线化疗方案进行的评估中,反应率的范围很大(0%-64%),有关生存结果的数据很少,且由于只有一项试验是随机进行的,缺乏明确的比较效益。不过,合作团队已开发出几种基于替莫唑胺(T)、可添加新型药物的骨干化疗方案。
抗血管生成疗法被用于多种成人癌症适应症,但此前还没有在儿童癌症中显示出明显的疗效。贝伐单抗(一种抗血管内皮生长因子VEGF的单克隆抗体)是最成熟的抗血管生成药物之一。贝伐单抗作为单药和联合用药(包括伊立替康-替莫唑胺 [IT] 以及其他抗VEGF疗法)的体外和体内临床前数据支持进行抗血管生成药物治疗神经母细胞瘤的评估。
近日,欧洲多国联合团队在 Journal of Clinical Oncology 发表了题为 Bevacizumab, Irinotecan, or Topotecan Added to Temozolomide for Children With Relapsed and Refractory Neuroblastoma: Results of the ITCC-SIOPEN BEACON-Neuroblastoma Trial 的研究,发布了替莫唑胺(T)联合新靶向疗法伊立替康(I)、托泊替康(To)的骨干化疗方案和添加抗血管生成药物贝伐单抗(B)的开放标签、多中心、多臂、多阶段、因子设计、随机二期试验结果。贝伐单抗-伊立替康-替莫唑胺(BIT)在该研究中取得了较好的结果,然而B治疗组的患者比非B组的患者出现了更多的不良事件,IT组和TTo组也比单独接受T治疗的患者发生的不良事件更多。

BEACON-Neuroblastoma试验有两个主要目的:
-
确定添加新靶向疗法的最佳骨干化疗方案:T、IT或TTo;
-
在随机二期试验中确定添加B(贝伐单抗)对难治/复发性神经母细胞瘤的作用。
160名1 岁到 21 岁的患者入组该二期临床试验,纳入标准为确诊高风险神经母细胞瘤、疾病状态为复发或一线疗法难治、病变可用I123 MIBG扫描测量或评估、此前未用T、B或I治疗过。
2013年启动时,试验采用 2*2 因式设计,患者被随机分配到两种化疗方案T或IT,再随机分配到加或不加 B。2015 年, 托泊替康-替莫唑胺(TTo)二期试验结果公布后,该试验进行了修订,以评估第三种化疗方案TTo,并将设计改为 3*2 因式试验。IT 治疗组于2017年达到预期目标后,试验又恢复为 2*2 因式设计。
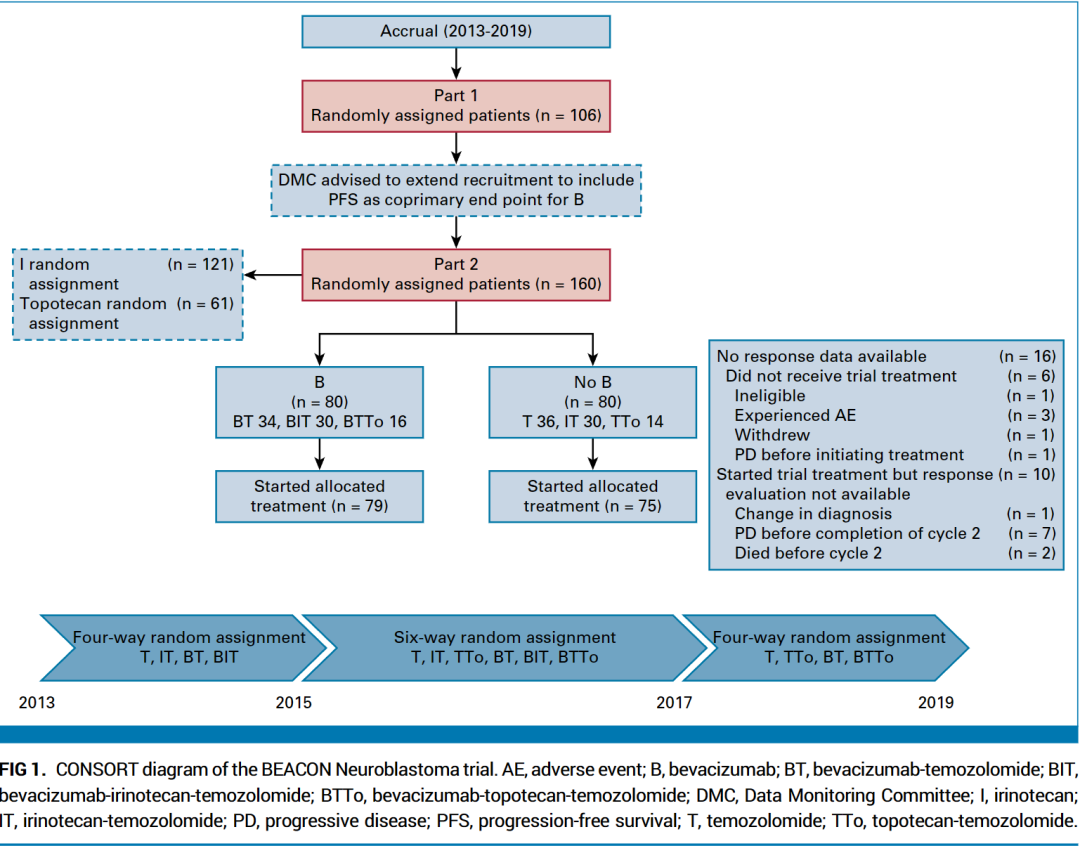
试验患者分组及时间线
试验的中位随访时间为 1.5 年(IQR,0.7~3.2 年)。
B 组 80 例患者中有 21 例出现客观反应(ORR,26% [95% CI,17-37]),非 B 组 80 例患者中有 14 例出现了客观反应(ORR,18% [95% CI,10-28]),RR 为 1.52(95% CI,0.83-2.77;P=.17)。符合 P < .2 的 ORR 预定成功标准。
IT 组的60 例患者中有 12 例出现了客观反应(ORR,20% [95% CI,11-32]);T 组的 61 例患者中有 13 例出现了客观反应(ORR,21% [95% CI,12-34]),RR 为 0.94(95% CI,0.47 至 1.89)。
TTo组的30例患者中有8例出现客观反应(ORR,27% [95% CI,12-46]),T组的31例患者中有7例出现了客观反应(ORR,23% [95% CI,10-41])。RR为1.22(95% CI,0.51至2.94)。
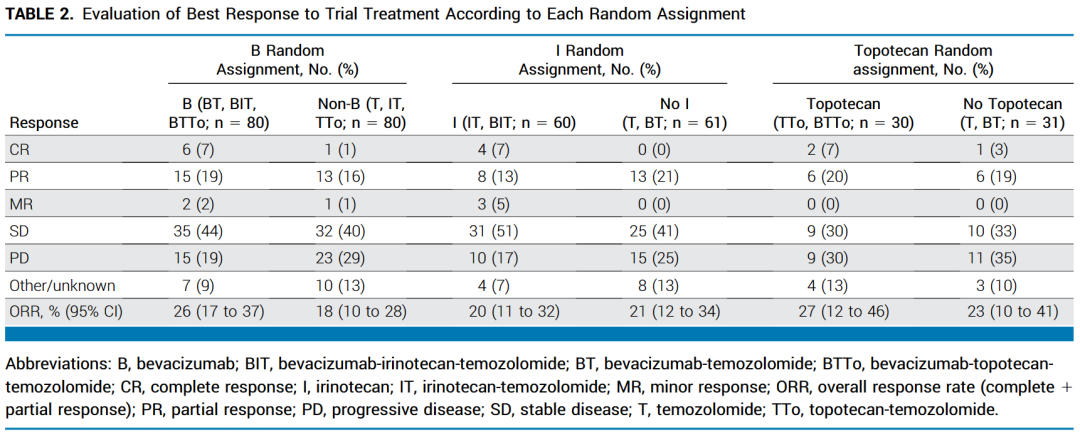
根据B、I、To随机分配分析试验治疗的最佳反应
对比非B组,B组的无进展生存期风险比为 0.89(95% CI,0.63 至 1.27),总生存期的风险比为 1.01(95% CI,0.70 至 1.45)。
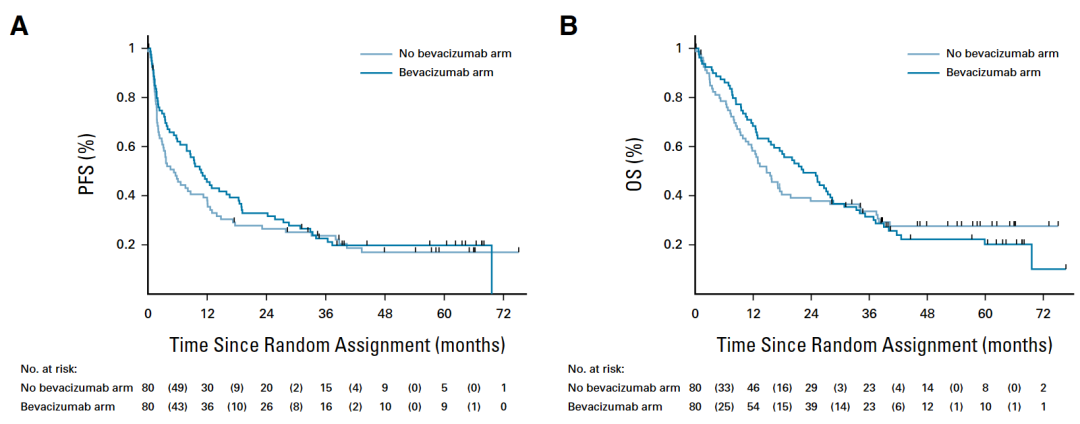
B组和非B组的无进展生存期与总生存期对比
与T组的患者相比,IT 组患者无进展生存期的风险比为 0.59(95% CI,0.39 至 0.90),总生存期的风险比为 0.65(95% CI,0.43 至 0.99)。
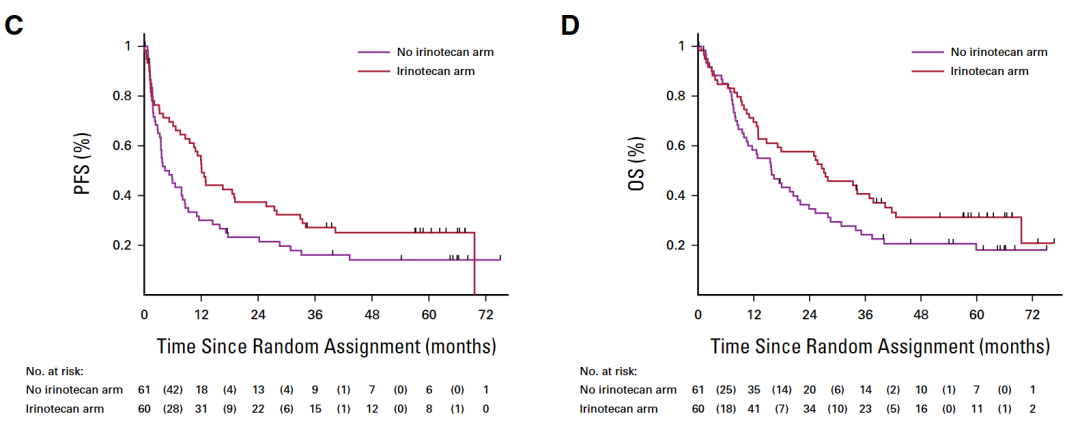
I组和非I组的无进展生存期与总生存期对比
与T组的患者相比,TTo组患者无进展生存期的风险比为 0.59(95% CI,0.33 至 1.08),总生存期的风险比为 0.80(95% CI,0.44 至 1.45)。
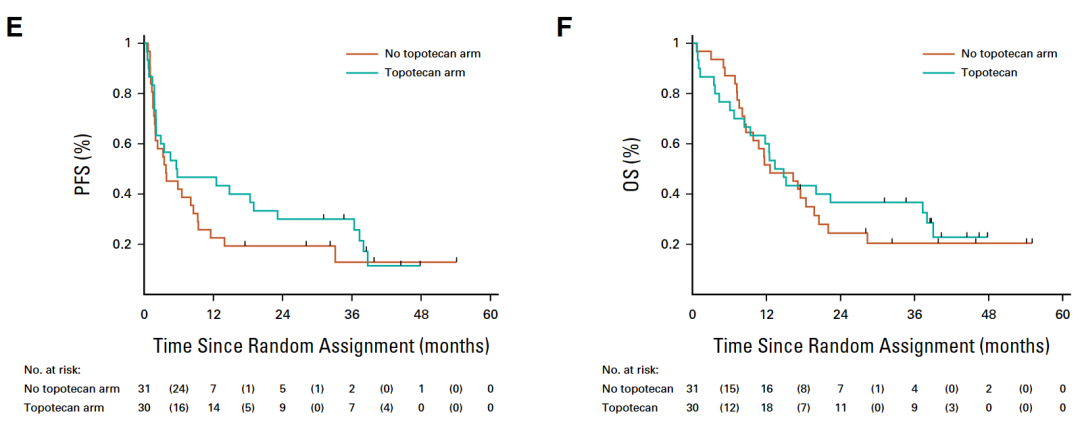
To组和非To组的无进展生存期与总生存期对比
试验设计假定 B 与不同化疗方案之间没有相互作用,在试验结束后通过异质性检验探索了交互作用。针对无进展生存期的未调整异质性检验显示,I与B之间存在一些潜在的交互作用,但对于总生存期和To则不存在交互作用。
这种相互作用在生物学上是合理的:虽然 B 主要是一种抗血管生成剂,但它对肿瘤免疫微环境有许多影响,包括促进肿瘤浸润淋巴细胞,抑制髓源性抑制细胞、调节性 T 细胞和 M2 巨噬细胞的数量和功能。伊立替康也有免疫和抗血管生成作用,包括消耗调节性 T 细胞、上调主要组织相容性复合体 I 类和 PD-L1 表达。
BIT组患者的1年和2年无进展生存期估计值分别为0.67(95% CI,0.47至0.80)和0.50(95% CI,0.31至0.66),1年和2年总生存期的估计值分别为0.77(95% CI,0.57至0.88)和0.73(95% CI,0.54至0.86)。
然而,BEACON试验的结果与一个单机构单臂试验的结果不同,后者显示将B添加到IT化疗中对接受过很多治疗的神经母细胞瘤患者没有益处。
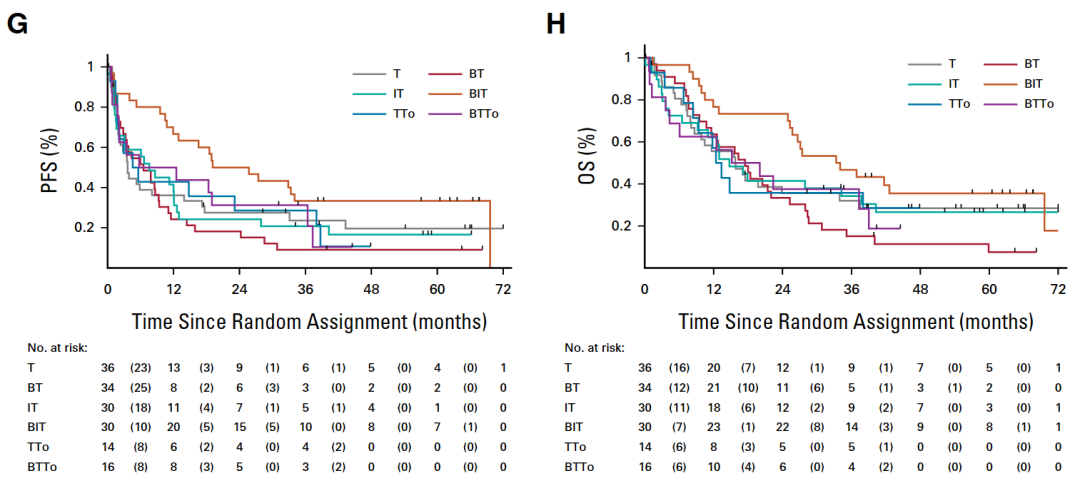
所有治疗组的无进展生存期与总生存期对比
B组的患者比非B组的患者出现了更多的不良事件,包括中性粒细胞减少、贫血和血小板减少、蛋白尿。B组的四名患者(5%)出现了≥3 级蛋白尿,而单独接受化疗的患者中没有出现蛋白尿。接受I或To治疗的患者也比单独接受T治疗的患者发生的不良事件更多。接受I治疗的患者发生≥3级消化道不良反应的几率增加,其中8名患者(13%)主要出现腹泻。接受To治疗的患者发生≥3级中性粒细胞减少症、血小板减少症和贫血的几率增加。
总之,BIT组合在该研究中取得了较好的结果。同时,在基于T的化疗中添加B提高了总反应率,符合预先设定的成功标准。而添加I或To改善了无进展生存期。I和B之间的潜在交互作用可能是BIT方案取得更好结果的原因。毒性分析证实,加入I会导致更多腹泻和消化道症状,而加入To会增加骨髓毒性,添加B主要与骨髓毒性增加有关。
在此之前,三种化疗方案中哪一种更适合治疗复发/难治性神经母细胞瘤还存在很大的不确定性;所有方案都在单臂系列试验中显示出良好的活性,且反应率相似,国际上普遍根据医生的偏好使用这些方案。确定最合适的骨干化疗方案对于评估未来治疗的新型疗法组合至关重要,且只有随机对照比较才能提供必要的数据。试验治疗期间收集的血浆、血液和肿瘤样本正在由一项转化研究计划(BEACON BIO)进行分析,以便于更好地了解难治/复发的生物学特性以及确定治疗反应或耐药性的生物标志物。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#化疗# #抗血管生成药物# #神经母细胞瘤#
52