J Hepatol:深圳市人民医院刘利平团队发现谷氨酰胺代谢在肝细胞癌进展中的重要作用
2023-10-31 iNature iNature 发表于上海
该研究发现缺氧反应基因SLC25A15缺乏通过重编程谷氨酰胺代谢促进肝细胞癌
尿素循环的关键组成部分SLC25A15在肝细胞癌(HCC)进展中的作用仍然知之甚少。
2023年10月27日,深圳市人民医院刘利平团队在Journal of Hepatology在线发表题为“Deficiency in SLC25A15, a hypoxia-responsive gene, promotes hepatocellular carcinoma by reprogramming glutamine metabolism”的研究论文,该研究发现缺氧反应基因SLC25A15缺乏通过重编程谷氨酰胺代谢促进肝细胞癌。SLC25A15在HCC组织中的表达明显降低,SLC25A15水平低的患者预后较差。缺氧暴露的HCC细胞或组织SLC25A15表达较低。缺氧抑制转录因子HNF4A与SLC25A15在HCC组织和细胞中均存在正相关。调节HNF4A水平改变SLC25A15 mRNA水平。SLC25A15上调SLC1A5,增加谷氨酰胺摄取。
在SLC25A15缺失的HCC细胞中,谷氨酰胺的反应性代谢途径增加,通过额外的脂质合成为HCC进展提供能量。低SLC25A15水平导致的氨积累抑制了OGDHL的表达,OGDHL是一种介导SLC25A15缺乏诱导的谷氨酰胺代谢重编程的开关基因。SLC25A15缺陷HCC细胞对谷氨酰胺剥夺和谷氨酰胺酶抑制剂更敏感。干预谷氨酰胺代谢增加SLC25A15缺陷HCC细胞对抗PD-L1治疗的反应。总之,SLC25A15在HCC中具有缺氧反应性,低水平的SLC25A15通过SLC1A5和OGDHL调控导致谷氨酰胺重编程,促进HCC进展并调节细胞对抗PD-L1的敏感性。中断谷氨酰胺来源的能量供应是治疗SLC25A15缺陷HCC的潜在治疗策略。

肝细胞癌(HCC)占原发性肝癌的90%以上,是全球癌症相关死亡的第二大原因。HCC患者生长迅速,转移频率高,治疗耐药,易复发,长期生存率不理想。因此,有必要充分了解HCC进展的详细分子机制,寻找新的治疗策略,加强经典治疗。
尿素循环发生在肝脏;它对从细胞中解毒氨很重要,是氨基酸代谢的中心。尿素循环失调在HCC患者中普遍存在,由此产生的氨和其他有毒代谢物的积累可触发代偿性代谢重编程,增加HCC恶性。先前关于HCC中尿素循环功能障碍的研究主要集中在相关的核心酶上,如氨甲酰磷酸合成酶1 (CPS1)、鸟氨酸转氨基甲酰基酶(OTC)、精氨酸琥珀酸合成酶(ASS1)、精氨酸琥珀酸裂解酶(ASL)、精氨酸酶1 (ARG1)和精氨酸酶2 (ARG2)的缺乏或低表达。很少有研究关注尿素循环转运失调与HCC之间的关系。
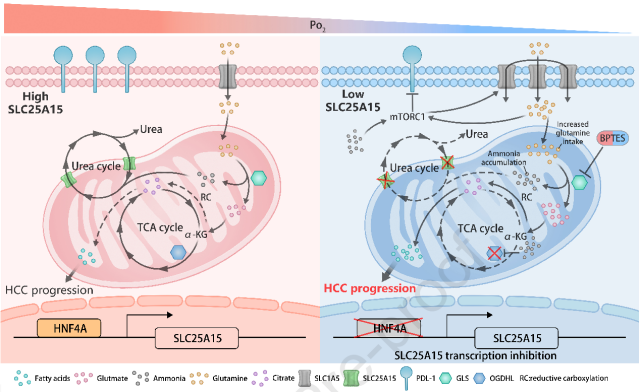
机理模式图(图源自Journal of Hepatology )
SLC25A15是线粒体载体家族的一员,它通过线粒体内膜将鸟氨酸从细胞质转运到线粒体基质;因此,它是肝细胞尿素循环的关键组成部分。已有研究将SLC25A15与前列腺癌和黑色素瘤联系起来,但其在HCC进展和能量代谢中的详细功能和机制仍不清楚。
总之,该研究证明了SLC25A15水平降低在HCC中的临床意义。SLC25A15缺失通过谷氨酰胺代谢重编程导致HCC进展,而OGDHL介导低水平SLC25A15诱导的还原性谷氨酰胺代谢的增强。SLC25A15水平可能是HCC的预后生物标志物,有助于开发有效的治疗方法。对于SLC25A15缺乏症患者来说,从谷氨酰胺中剥夺HCC细胞的能量可能是一种有益的治疗策略。当与抗PD-L1等ICBs联合使用时,这种益处可能会进一步增强。
原文链接:
https://doi.org/10.1016/j.jhep.2023.10.024
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言