Hypertension:PD-1/PD-L1 在缺氧诱导的肺血管重塑中发挥保护作用
2024-06-12 刘少飞 MedSci原创 发表于上海
本研究揭示了PD-1/PD-L1通路通过抑制Th17细胞反应和改善内皮功能障碍,显著缓解缺氧诱导的肺动脉高压,为PD-1/PD-L1免疫调节治疗提供了新的潜在应用前景。

背景
缺氧诱导的肺动脉高压(HPH)是一种严重的肺血管疾病,其病理机制复杂,涉及多种细胞和分子通路。研究表明,辅助性T细胞17型(Th17)在HPH的发展中起到关键作用。Th17细胞通过分泌多种促炎性细胞因子,加剧了肺血管的炎症反应和重构。此外,近年来有研究报道了与PD-1(程序性细胞死亡1)/PD-L1(程序性细胞死亡配体1)抑制剂相关的肺动脉高压,这引起了人们对PD-1/PD-L1通路在HPH中的作用的关注。本研究旨在探讨PD-1/PD-L1通路是否通过调节内皮功能障碍和Th17细胞反应参与HPH的发生发展。
方法
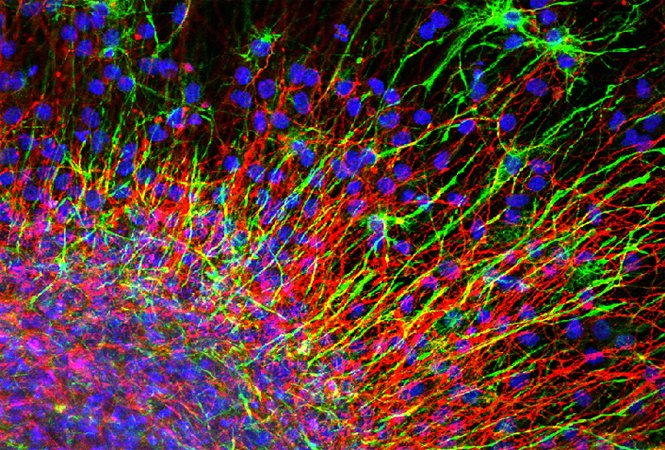
为了验证这一假设,我们从符合条件的患者中获取了肺组织样本。通过Western blot、免疫组织化学和免疫荧光技术评估样本中的蛋白表达水平。同时,利用免疫共沉淀技术检测蛋白的泛素化水平。我们在C57BL/6 WT(野生型)和PD-1-/-小鼠中建立了HPH模型,并通过给予PD-L1重组蛋白进行治疗。此外,使用腺相关病毒载体在小鼠肺内皮细胞中上调PD-L1的表达。为了评估内皮细胞功能,我们进行了细胞成血管和粘附实验。
结果
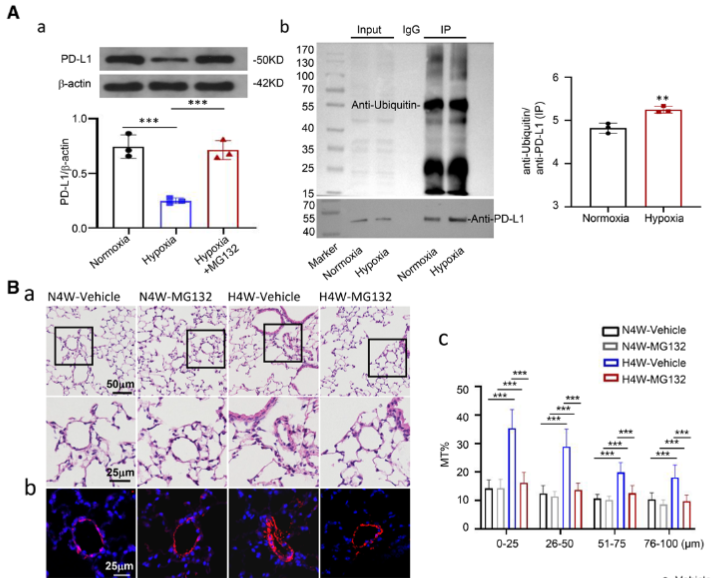
我们的研究发现,HPH患者和小鼠模型中PD-1/PD-L1通路的表达显著下调,尤其是在内皮细胞中,PD-L1的表达显著减少。与常氧组相比,缺氧环境下的WT小鼠表现出典型的HPH病理特征,包括右心室肥大和肺动脉压力升高。而PD-1-/-小鼠在同样的缺氧条件下表现出更为严重的HPH表型,这表明PD-1/PD-L1通路在调节HPH发展中起到保护作用。
进一步的实验显示,给予PD-L1重组蛋白以及通过腺相关病毒载体在肺内皮细胞中过表达PD-L1,可以显著减轻HPH的症状。这一发现提示PD-L1在缓解HPH方面具有潜在的治疗作用。在体外实验中,使用中和抗体阻断PD-L1后,内皮细胞的成血管能力、粘附能力和细胞焦亡均显著增加,这表明PD-L1在维持内皮细胞功能和抑制病理性血管重构中起到重要作用。
从机制上看,缺氧环境通过泛素化途径下调了PD-L1蛋白的表达。此外,无论是在体内还是体外实验中,PD-L1通过抑制PI3K(磷脂酰肌醇3-激酶)/AKT(蛋白激酶B)/mTOR(哺乳动物雷帕霉素靶蛋白)信号通路,减少了Th17细胞反应。这一发现进一步说明了PD-1/PD-L1通路在HPH中的保护性作用。
讨论
本研究首次系统地阐明了PD-1/PD-L1通路在HPH中的作用机制。我们的研究结果表明,PD-1/PD-L1通路通过抑制Th17细胞反应和改善内皮功能障碍,在缓解HPH发展中起到了关键作用。这一发现不仅为理解HPH的发病机制提供了新的视角,也为开发基于PD-1/PD-L1通路的免疫调节治疗提供了理论依据。
结论
PD-1/PD-L1通路在HPH的发生发展中起到了重要的调节作用。通过抑制Th17细胞反应和改善内皮功能障碍,PD-1/PD-L1通路可以缓解HPH的发展。因此,基于PD-1/PD-L1的免疫调节治疗在HPH治疗中具有潜在的应用前景。这一发现为HPH患者提供了新的治疗希望,未来的研究应进一步探索PD-1/PD-L1通路在HPH中的具体作用机制,并评估其在临床应用中的安全性和有效性。
原始出处:
Wang L, Mu M, Guo Y, Huang J, Zhang R, Zhang M, Hu Y, Wang Y, Gao Z, Liu L, Wang W, Cheng Y, Zhu X, Liu J, Wang W, Ying S. PD-1/PD-L1 Provides Protective Role in Hypoxia-Induced Pulmonary Vascular Remodeling. Hypertension. 2024 Jun 10. doi: 10.1161/HYPERTENSIONAHA.123.22393. Epub ahead of print. PMID: 38853755.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#肺血管# #PD-1/PD-L1#
56