Nature:11种癌症类型的综合多组学图谱揭示癌症转变过程的表观遗传调控
2023-11-29 测序中国 测序中国 发表于上海
研究团队利用snATAC-seq和snRNA-seq,对包含11种主要癌症类型的225个肿瘤样本进行分析,构建了一个综合多组学图谱。
转座酶可及性染色质测序(ATAC-seq)是一种快速、灵敏的分析方法,被广泛应用于染色质生物学的研究中。最近,单核ATAC-seq(snATAC-seq)的发展为检测单细胞表观基因组提供了更大的分辨率。将snATAC-seq与单核RNA测序(snRNA-seq)结合,可以同时分析同一细胞的表观基因组和转录组,从而直接分析染色质可及性和基因转录之间的关系。
近日,美国圣路易斯华盛顿大学、普林斯顿大学等机构的研究人员合作在Nature上发表了题为“Epigenetic regulation during cancer transitions across 11 tumour types”的文章。研究团队利用snATAC-seq和snRNA-seq,对包含11种主要癌症类型的225个肿瘤样本进行分析,构建了一个综合多组学图谱;确定了与癌症相关的表观遗传驱动因素,并强调了转录因子(TF)作为预后标志物的潜力。

文章发表于Nature
作为NCI人类肿瘤图谱网络(HTAN)的一部分,研究团队从201名患者中收集了225个样本,包括158个原发性肿瘤样本、52个转移性肿瘤样本和15个正常邻近组织(NAT),共涵盖11种癌症类型(图1)。其中,转移肿瘤转移样本分别来自结直肠癌(CRC)、胰腺导管腺癌(PDAC)、皮肤黑色素瘤(SKCM)、子宫内膜癌(UCEC)、卵巢癌(OV)和乳腺癌(BRCA)。研究团队对上述样本进行snATAC-seq分析,并对其中206个样本进行了配对sc/snRNA-seq分析;还生成了195个样本的全外显子组测序(WES)数据。 结果显示,研究团队鉴定出225个样本的可及染色质区域(ACR),其中大部分出现在内含子、远端基因间和启动子区域。
为了解正常细胞向癌细胞转变过程中的遗传和表观遗传变化,研究团队依据染色质可及性和基因表达将癌细胞和正常细胞相关联。结果显示,共确定了56,001个组织和癌细胞特异性染色质区域(DACR),53%的DACR位于增强子区域,37%位于启动子区域,这提示其与基因表达变化存在功能相关性;约有75%的DACR与最近基因表达变化方向匹配。研究团队进一步确定了癌症细胞特异性DACR中富集的标志通路,包括缺氧通路、TNF信号通路。

图1.11种癌症类型的染色质可及性模式
研究团队对来自8种癌症类型的122个肿瘤样本中大量恶性细胞核进行测序,并检测了超50万个增强子ACR,以预测调节基因表达的增强子ACR(图2)。结果显示,对癌症类型和原发组织而言,增强子元件的可及性比启动子可及性更具特异性;与启动子可及性相比,增强子可及性更能反映转录本的表达,表明其在调控基因表达方面起着重要作用。
为预测ACR和基因表达之间的调控关系,研究团队计算了基于相关性的ACR与基因的关联。在所有重要关联中,近一半是基因与EpiMap增强子区域之间的关联;大多数关联具有癌症类型特异性。
为确定可能与正常细胞向原癌细胞转变有关的ACR-基因关联,研究团队比较了DACR和差异表达基因(DEG)。在原发性PDAC肿瘤中观察到有397个关联的ACR(其中大多数是增强子)获得了可及性。ACR与基因关联的其他显著例子包括:TF基因KLF6和PPARG,分别与一个和两个在PDAC癌细胞中获得可及性的增强子关联。PDAC的另一个不利预后的标志物FLNB与5个增强子区域相关,上述结果表明存在广泛的表观遗传调控。
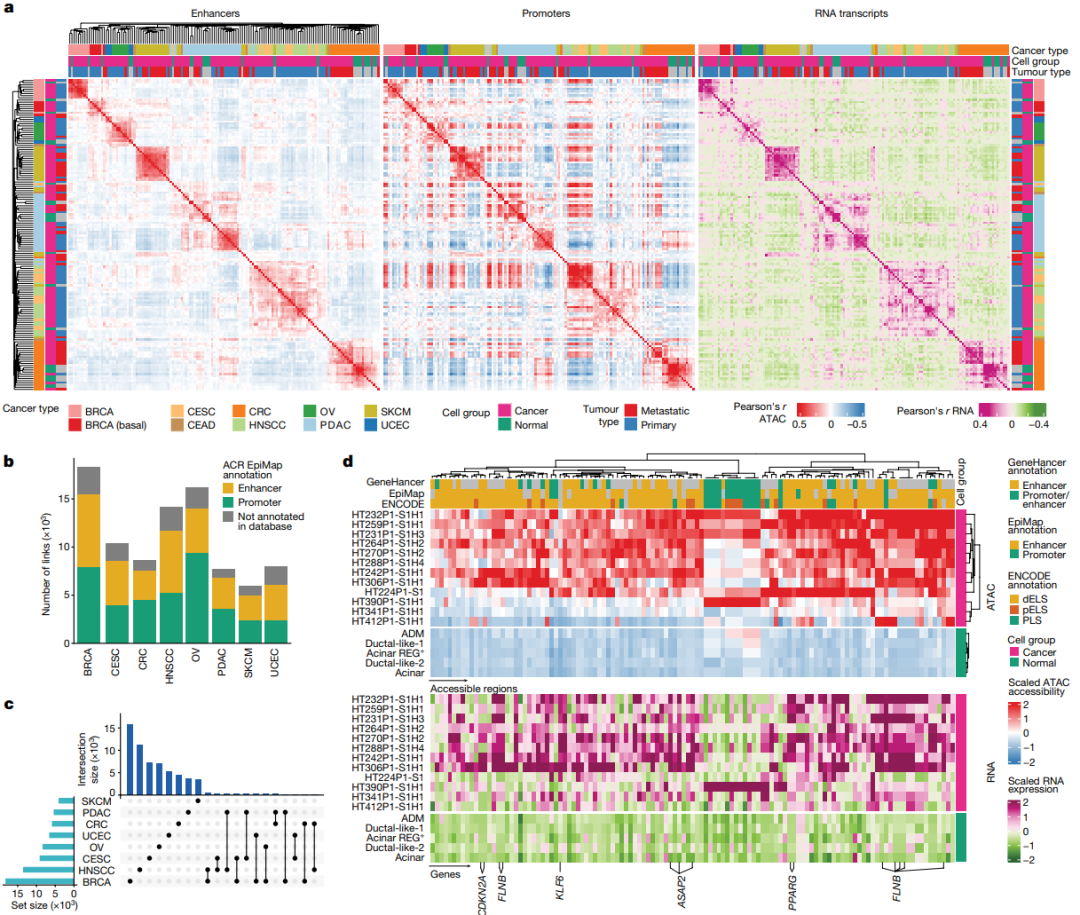
图2.调控癌症转录程序的顺式调控元件(CRE)
为更好地了解癌症发展相关的转录调控,研究团队试图定义影响细胞状态的TF靶基因,使用SCENIC35在每个癌症队列中确定TF与其靶基因(即调控子)之间的调控关系(图3)。结果显示,TF与其表达一致的靶基因共构成了258个调控子,每个调控子包含20-4,310个靶基因;其中87个调控子对某些癌症类型表现出高度特异性。在这些调控子中,研究团队观察到41个调控子具有组织特异性,46个调控子具有癌细胞特异性;一些调控子在恶性细胞中显示出活性增强。
通过进一步验证,研究团队发现癌细胞特异性调控子的靶基因富集于癌症特异性通路,表明其参与了癌症相关过程;与随机基因相比,21个TF的靶基因更有可能与含有这些TF结合基序的ACR相结合,这揭示了靶基因表达、ACR可及性和TF活性之间存在联系。

图3.泛癌症和癌症特异性调控子
研究队列对来自6种肿瘤类型的52个转移样本进行分析,其中有9个病例具有配对的原发-转移样本(图4)。首先比较了4个队列(SKCM、CRC、PDAC和UCEC)原发肿瘤样本和转移样本的癌细胞,发现了几个重要的预后标志物。
为确定从原发到转移过程改变活性的TF,研究团队比较了上述4种癌症中原发癌细胞和转移癌细胞的 TF motif(基序)可及性评分。在 CRC 中,与原发癌细胞相比,有几个TF(TWIST1、PBX3)motif在转移癌细胞具有更高的可及性;在PDAC中,ELF3和GATA6是motif可及性降低最显著的TF。此外,多个FOX家族的TF在多种癌症中下调最显著。这些结果表明,在不同癌症的转移过程中,既有共同的TF,也有特异性TF。
研究团队分析了9例具有配对的原发-转移样本snATAC-seq数据,并对肿瘤细胞和正常上皮细胞进行轨迹分析,发现所有配对的原发-转移样本都遵循一条线性轨迹,从正常细胞逐渐发展到原发细胞再到转移细胞;样本的轨迹与已知的上皮细胞-间充质转化(EMT)特异性基因、与转移有关的基因(如SNAI1 和PBX3)呈正相关。
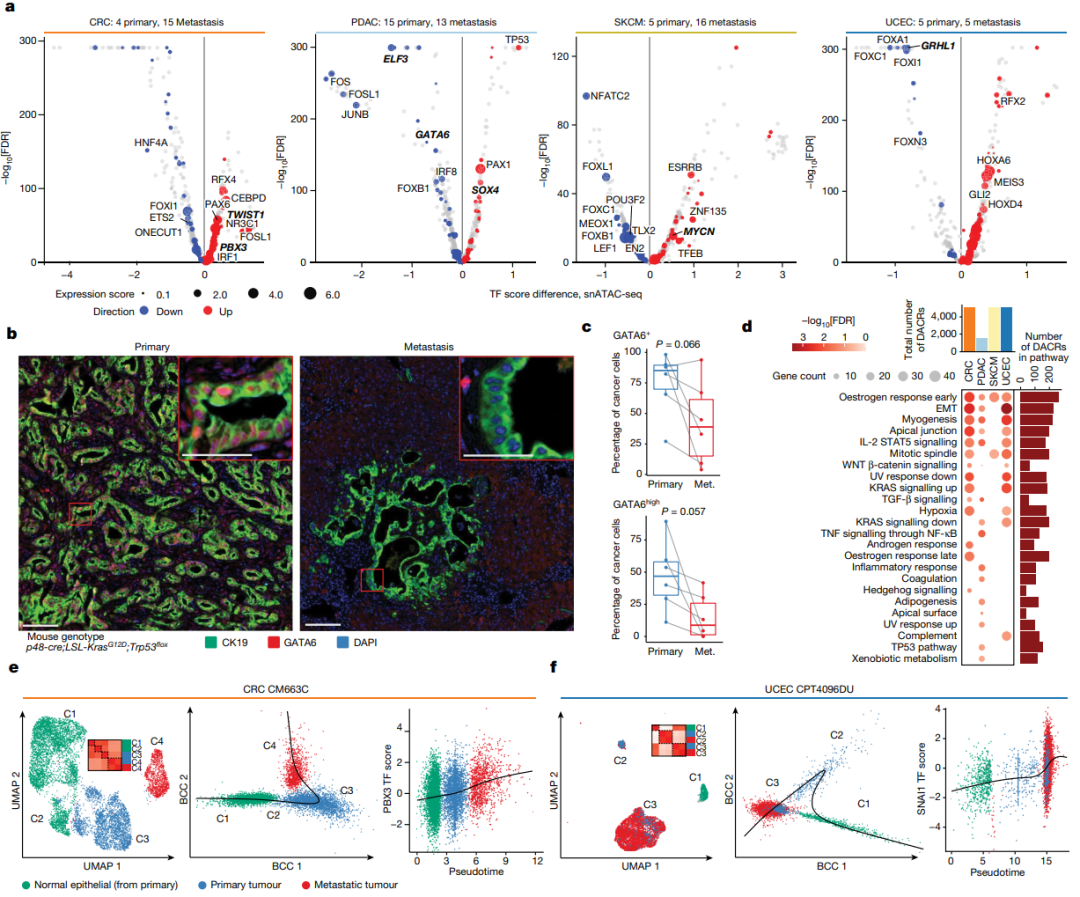
图4.癌症转移过程中激活的表观遗传学程序
为进一步确定表观遗传驱动因素与遗传驱动因素如何相互作用,研究团队对176个具有WES数据的肿瘤样本进行体细胞突变和拷贝数变异(CNV)的遗传表征(图5)。与snATAC-seq数据相比,批量WES中TERT启动子(TERTp)突变的变异等位基因频率较低,这表明 snATAC-seq 能够检测诱导染色质可及性的突变。
研究团队通过将癌基因的表达与增强子的可及性相关联,评估了癌基因的表观遗传调控。结果显示,有30个癌基因的表达与增强子的可及性相关联,揭示了表观遗传和遗传驱动因素之间的“协作”致癌作用。
为评估与治疗相关的基因和表观遗传学改变,研究团队还确定了可作为药物靶点的癌症特异性DEG和DACR;并发现了目前尚未应用于临床的潜在靶点,包括EGFR在透明细胞肾细胞癌 (ccRCC)中的可及性,TOP1在UCEC、多发性骨髓瘤(MM)和ccRCC中的表达,以及FGFR2在胶质母细胞瘤(GBM)、ccRCC和基底样BRCA中的表达。
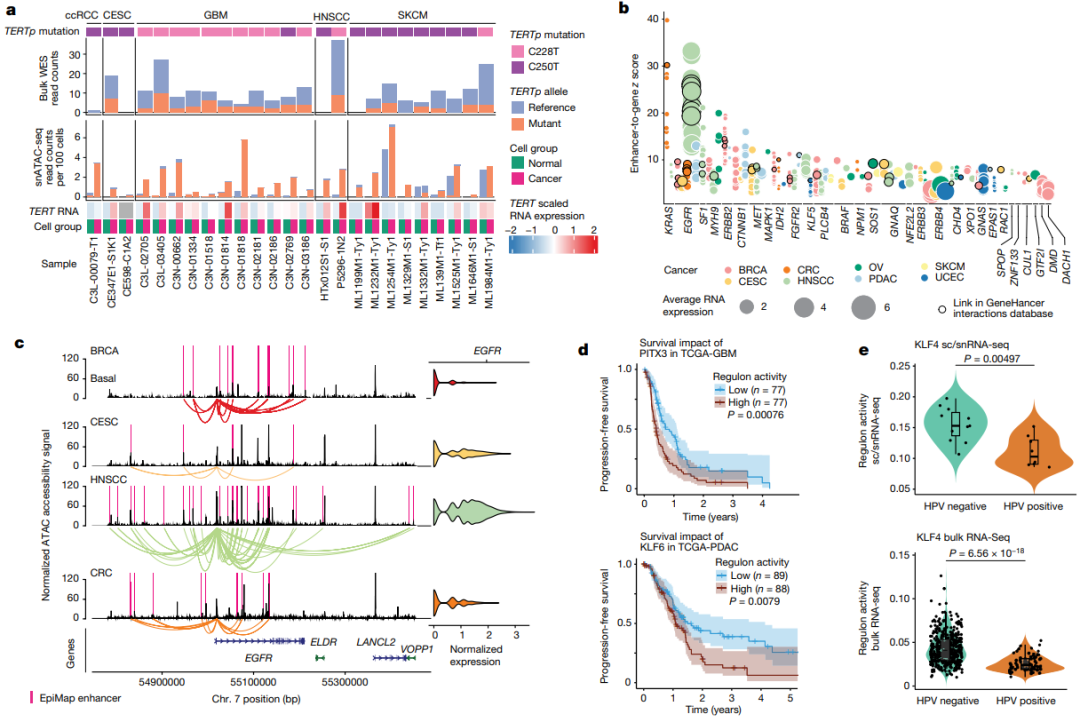
图5.基因驱动因素对染色质可及性的影响
综上所述,研究团队构建了来自11种癌症类型225个样本的大规模单细胞多组学图谱,揭示了不同的癌症和正常组织细胞类型。该研究加深了人们对正常细胞向癌细胞、从原发癌向转移性癌转变时染色质可及性的变化以及染色质可及性、遗传改变和转录模式之间相互作用的理解;并提示染色质可及性的某些变化代表了癌症发生和转移扩散的关键事件/驱动因素,可能是潜在的治疗靶点。
参考文献:
Terekhanova NV, Karpova A, Liang WW, et al. Epigenetic regulation during cancer transitions across 11 tumour types. Nature. 2023;623(7986):432-441. doi:10.1038/s41586-023-06682-5
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#癌症# #测序技术# #综合多组学图谱#
85