刷新认知!三篇Nature同期独立发表,揭秘ecDNA的起源、遗传和传播致癌特性
2024-11-23 测序中国 测序中国 发表于陕西省
Nature 同期三篇论文探讨染色体外 DNA,包括其起源及影响、在肿瘤细胞中的协同遗传机制,以及潜在治疗靶点,为癌症治疗提供新思路。
染色体外DNA(ecDNA)是一种存在于细胞核,但独立于染色体的环状DNA分子,由于ecDNA在有丝分裂过程中缺乏中心粒,导致其在细胞分裂时不均匀遗传,从而促进了肿瘤内遗传异质性、拷贝数高度升高,推动肿瘤快速进化,是癌症治疗抗性和患者不良预后的主要因素。但科学界对ecDNA的研究还比较有限,如ecDNA有什么样的功能?在癌症发生发展中的作用机制是什么?临床中哪些癌症患者会受到影响?ecDNA又是如何在癌细胞中遗传的?是否可针对ecDNA开发特异性靶向药物?
近日,Nature同期发表三篇重磅研究论文,斯坦福大学Paul Mischel教授领衔,eDyNAmiC团队及其国际合作者从不同角度探讨了ecDNA是如何形成、遗传和传播致癌特性的。研究结果刷新了人们对ecDNA的认知,这些环状DNA分子是许多人类癌症类型的一个主要驱动因素,是大量致癌基因表达的平台,以及形成赋予生存优势(如免疫系统抑制)的新型调控回路的基础。对ecDNA使癌症加速发展机制的深入研究为开发新的癌症治疗策略提供了潜在靶点。
01 ecDNA的起源及影响
在第一篇文章中,共同第一作者Chris Bailey和Oriol Pich等人通过分析目前可获得的最大癌症患者全基因组测序(WGS)样本集——10万基因组计划中14,778名患者的15,832个WGS癌症样本(涵盖39种肿瘤类型),发现17.1%的肿瘤样本含有ecDNA,不同组织来源的肿瘤中,ecDNA的基因组成及扩增程度存在显著差异,揭示ecDNA的形成可能与组织类型和基因组特征高度相关。

值得注意的是,ecDNA上癌基因富集,常见驱动型癌基因在ecDNA上频繁扩增,且ecDNA上的癌基因突变率更高。此外,ecDNA还通过扩增免疫调节基因来调节免疫系统,影响肿瘤免疫微环境,促进肿瘤快速进化。特别地,研究还发现了仅携带增强子、启动子和IncRNA元件的ecDNA,表明ecDNA之间具有反式相互作用的组合能力。临床分析发现,ecDNA与肿瘤分期相关,在靶向治疗和化疗后更为普遍,并且与转移和较短的总体生存期密切相关(图1)。因此,开发针对ecDNA的靶向治疗药物是未来研究的一个重要方向。
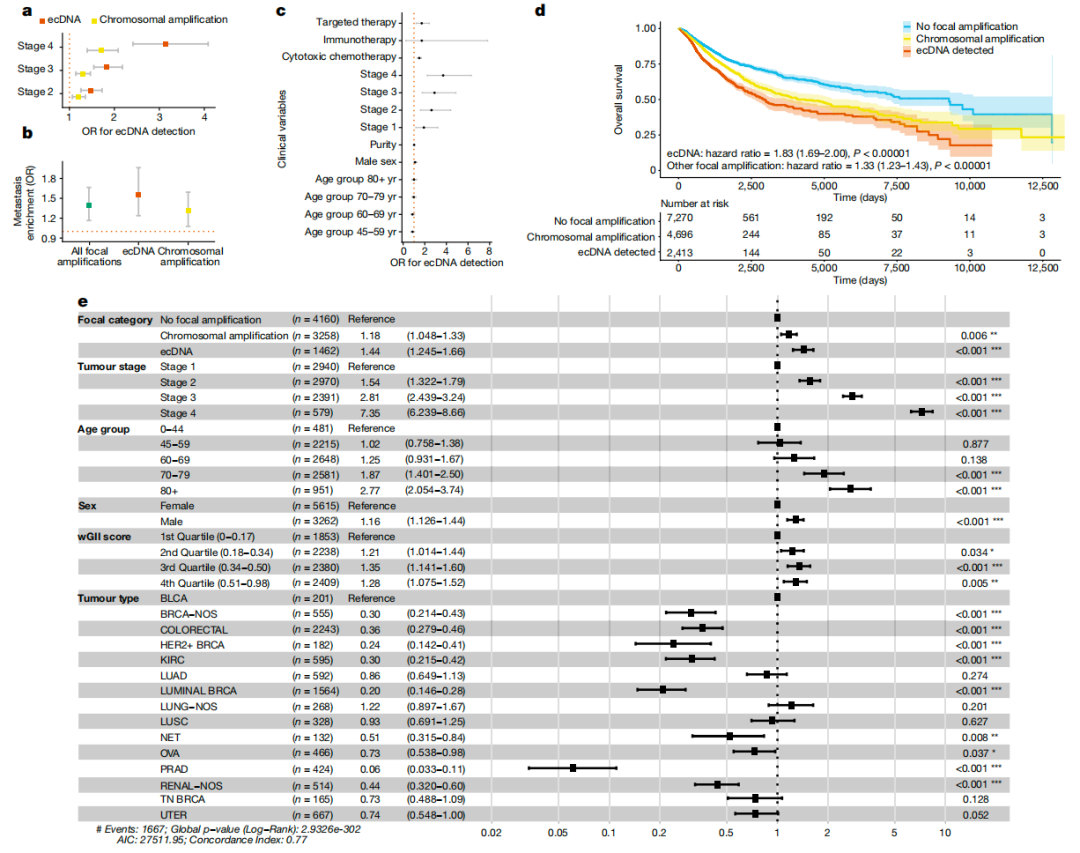
图1. ecDNA与临床结果
02 肿瘤细胞中ecDNA的协同遗传
ecDNA通过在细胞分裂过程中随机分离来驱动癌基因扩增、基因表达失调和肿瘤内异质性,但其在肿瘤细胞群体中的分布、遗传及对癌症进化的影响尚不清楚。在另一项平行研究中,King L. Hung等人通过分析1513例来自TCGA的WGS数据发现,编码不同癌基因的ecDNA倾向于在单一癌细胞系或同一肿瘤样本中共同存在且拷贝数呈正相关,提示不同ecDNA间可能存在协同作用机制。

聚焦细胞分裂过程,研究人员利用成像技术发现,在有丝分裂期间,不同于孟德尔遗传定律中不同染色体上基因独立分配的规律,不同ecDNA物种倾向于共同分离到子细胞,其相关性高于随机分离,且分子间接近和转录起始促进了这种协同分离,而转录抑制减少了协同分离(图2)。进一步地,研究人员构建进化模型进行分析,揭示ecDNA的共存受共选择压力和共分离协同驱动,细胞中ecDNA拷贝数相关性主要由共分离决定。ecDNA的协同遗传使只含有增强子元件的特殊ecDNA的共同扩增成为可能,赋予了癌基因协作和新型基因调控回路稳定性,使表观遗传状态组合在细胞世代间传递。如果能干扰ecDNA的协同遗传,可能会阻止癌基因的扩增,从而抑制肿瘤生长。
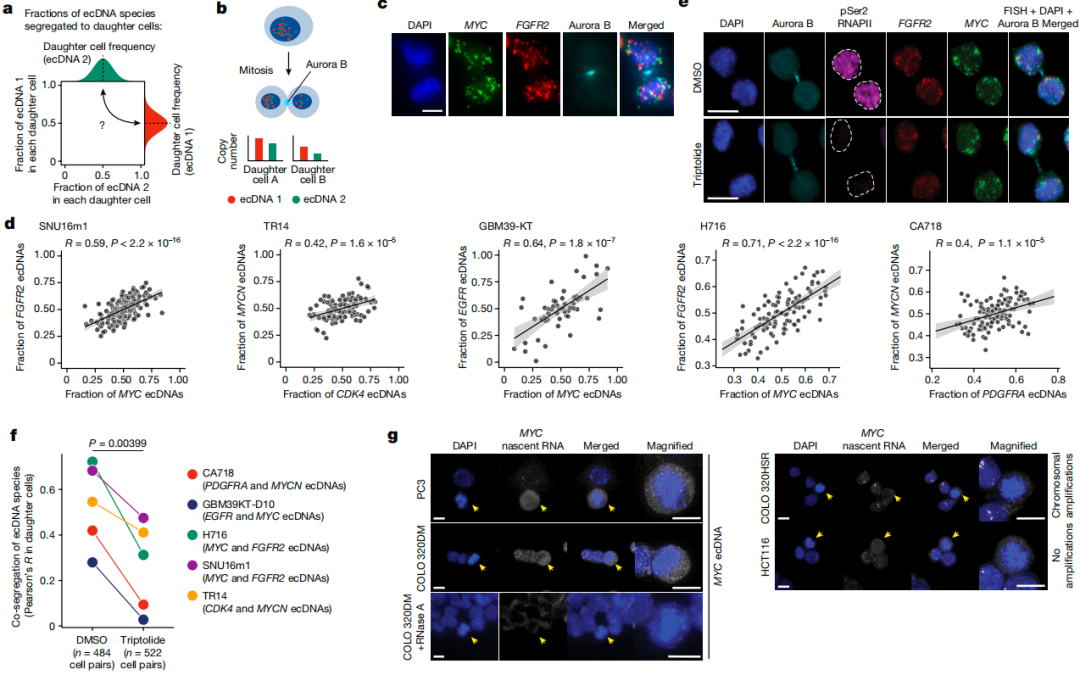
图2.有丝分裂过程中,不同ecDNA物种共分离到子细胞中
03 ecDNA的潜在治疗靶点
ecDNA给癌症治疗带来了重大挑战。ecDNA通过促进大量癌基因转录和快速的基因组进化,使肿瘤对治疗产生抗性,导致患者生存率低下。目前,尚无针对ecDNA的特异性治疗方法。
为此,Jun Tang等人首先通过GRO-seq和Ribo-Zero分析ecDNA的转录情况,发现ecDNA在癌细胞中具有高度的转录活性,导致广泛的RNA转录和相关单链DNA(ssDNA)的积累。ecDNA的广泛转录增加了转录-复制冲突的可能性,导致复制叉停滞、新核苷酸的掺入减慢,以及复制应激(RS)的增加。

转录-复制冲突激活S期检查点,使ecDNA阳性细胞中CHK1磷酸化水平升高。通过CRISPR敲除CHK1和使用不同CHK1抑制剂处理细胞,发现ecDNA阳性细胞对 CHK1抑制更敏感,可导致细胞死亡增加,这与CHK1抑制引发的复制原点异常激活和DNA损伤积累有关。分析显示,口服CHK1抑制剂BBI-2779单药或联合靶向治疗(英菲格拉替尼)均能抑制肿瘤生长,联合用药效果更显著,可抑制肿瘤细胞对英菲格拉替尼的获得性耐药,降低ecDNA上FGFR2拷贝数扩增,在胃癌模型小鼠中引起显著和持久的肿瘤消退。因此,转录-复制冲突可作为针对ecDNA指导治疗的靶点,利用过量的合成致死性来治疗癌症。
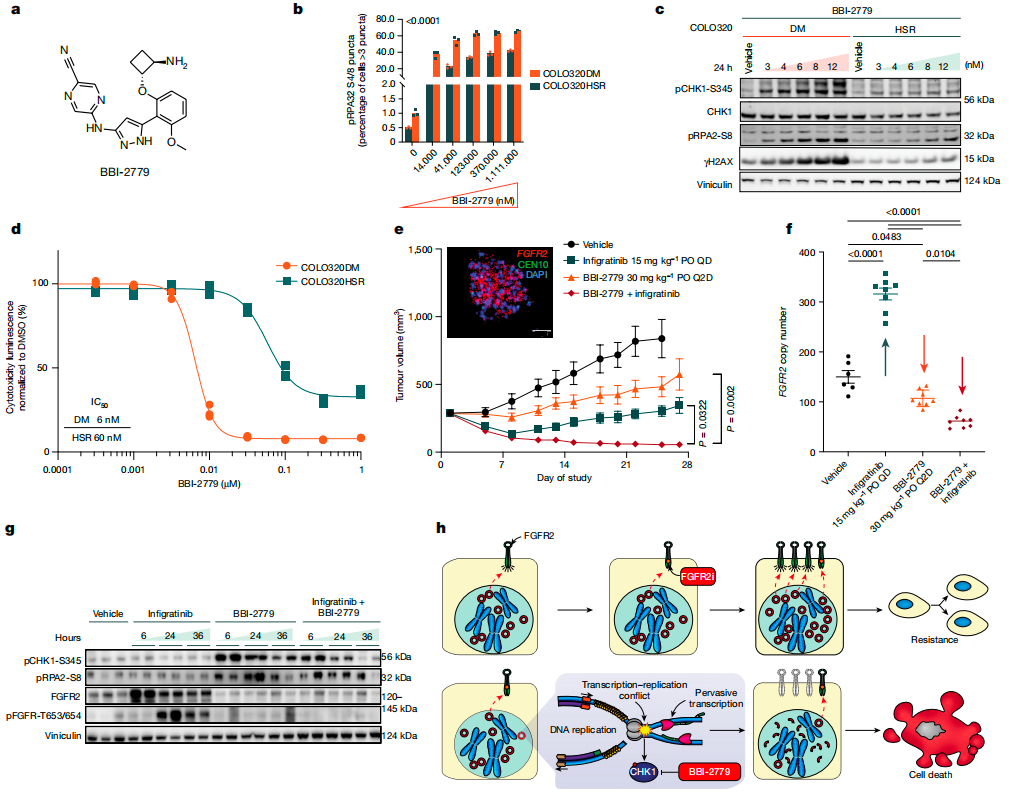
图3.口服CHK1抑制剂与泛FGFR抑制剂联合使用抑制ecDNA介导的获得性耐药。
论文原文:
1.Bailey C, Pich O, Thol K, et al. Origins and impact of extrachromosomal DNA. Nature. 2024 Nov;635(8037):193-200. doi: 10.1038/s41586-024-08107-3. Epub 2024 Nov 6. PMID: 39506150; PMCID: PMC11540846.
2.Hung KL, Jones MG, Wong IT, et al. Coordinated inheritance of extrachromosomal DNAs in cancer cells. Nature. 2024 Nov;635(8037):201-209. doi: 10.1038/s41586-024-07861-8. Epub 2024 Nov 6. PMID: 39506152; PMCID: PMC11541006.
3.Tang J, Weiser NE, Wang G, et al. Enhancing transcription-replication conflict targets ecDNA-positive cancers. Nature. 2024 Nov;635(8037):210-218. doi: 10.1038/s41586-024-07802-5. Epub 2024 Nov 6. PMID: 39506153; PMCID: PMC11540844.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#癌症治疗# #染色体外DNA#
17